Osteopatia Ricerca osteopatica
Quando la salute della schiena passa dall’intestino
Alla scoperta dei nuovi assi funzionali
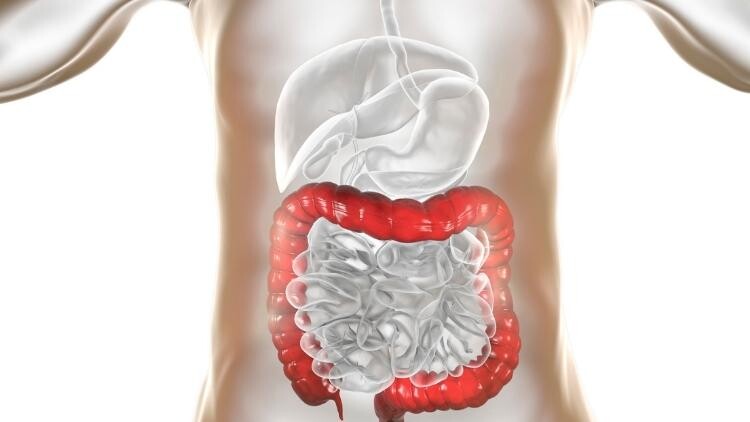
I processi degenerativi ed infiammatori del disco intervertebrale (IDD) sono da tempo nel mirino degli studiosi, tuttavia, la causa e l’esatta natura di questi fenomeni non è stata ancora pienamente compresa. Recentemente, in seguito alle scoperta delle associazioni fra microbioma (gastrointestinale, cutaneo ed orale) ed i disturbi infiammatori reumatici ed auto-immuni (es. artrite reumatoide, artrosi, spondilite anchilosante, artrite settica) è stata chiamata in causa anche la disbiosi (si veda, a scopo esemplificativo, gli altri link di approfondimento).
Da poco, è stata pubblicata una nuova review su European Spine Journal (2022), attraverso la quale gli autori Li W, Lai K, Chopra N et al. tentano di svelare i potenziali legami fra disbiosi, processi degenerativi del disco intervertebrale (IDD) e mal di schiena (LBP). Secondo quanto riportato in questo lavoro, i cambiamenti nella composizione del microbioma ed i suoi metaboliti associati potrebbero svolgere un ruolo chiave nella regolazione del LBP nei pazienti con IDD.
Legame tra disbiosi e processi degenerativi del disco intervertebrale: le osservazioni della letteratura
Come introdotto nel documento, in questi ultimi anni la scienza medica sta individuando un’articolata presenza di assi funzionali nel nostro organismo, molti dei quali sembrerebbero coinvolgere l’intestino. Pensiamo ad esempio all’asse intestino-midollo osseo, l’asse intestino-osso o l’asse intestino-disco intervertebrale. Tutti questi modelli potrebbero rivelarsi determinanti per la comprensione dei meccanismi patologici ed involutivi dello sviluppo osseo ma anche per i meccanismi di innesco o aggravamento della IDD. Ovviamente, questo discorso potrebbe ulteriormente concretizzarsi in un contesto di conclamata disbiosi (alterata composizione del microbioma).
Ad esempio, in una precedente ricerca, Rajasekaran et al. hanno confrontato la composizione microbiomica di un campione di individui con dischi intervertebrali (IVD) sani ed un gruppo di individui con IVD degenerati ed erniati, evidenziando una sostanziale differenza fra le due popolazioni di individui. In particolare, è stato rilevato come i Firmicutes, Actinobacteria e Saccharopolyspora siano abbondanti nel microbioma dei soggetti con IVD normali. Questi ceppi, sono normalmente correlati ad una buona funzionalità della barriera intestinale, nonché ad una positiva protezione antibatterica (es.i saccharopolyspora producono efficacemente antibiotici macrolidi contro la maggior parte dei batteri gram-positivi e alcuni batteri gram-negativi). Viceversa, nei pazienti con IVD degenerati ed erniati, sono stati riscontrati alcuni agenti patogeni come il Bacillus coagulans ed il Bacillus clausii, più volte implicati nella spondilodiscite, nelle fratture osse, nelle infezioni articolari, nella meningite e nell’endocardite. Inoltre, è stata riscontrata la presenza di Pseudomonas veronii, Pseudomonas stutzeri, Streptococcus anginosus ed altri ceppi potenzialmente collegati alle infezioni subcliniche ed alle risposte infiammatorie, portando i ricercatori ad individuare in questi patogeni un possibile nesso eziologico con la degenerazione discale.
Nell’insieme, tutte queste osservazioni inducono a confutare il dogma della “sterilità” dei IVD: la presenza di 58 specie batteriche sovrapposte tra gli IVD e l’intestino, nonché la presenza di 29 specie diverse tra IVD e la pelle, suggeriscono la possibile presenza di microbioma nei IVD ed una probabile comunicazione fra il microbioma IVD ed il microbiota intestinale. Inoltre, sarebbe confermato un preciso ruolo di alcuni ceppi batterici che, infiltrandosi nei IVD, possono generare IDD.
Basti pensare, ad esempio, come un batterio comunemente presente sulla pelle (Propionibacterium acnes) sia spesso rilevato in corso di osteomielite vertebrale e in caso di malattie infettive di ossa ed articolazioni. Inoltre, studi su modelli animali e umani hanno dimostrato come uno squilibrio persistente della comunità microbica sia in grado di indurire la secrezione di particolari citochine infiammatorie (es. TNF-a, IL-1ẞ e PGE-2) ed intermediari molecolari correlati all’IDD.
Asse intestino – disco
L’IVD è una complessa articolazione fibrocartilaginea avascolarizzata del corpo umano. I vasi sanguigni nell’IVD infatti esistono solo nei legamenti longitudinali e negli strati esterni dell’anulus fibrosus. Tuttavia, sappiamo che quando un’ernia discale penetra nello spazio epidurale (o quando sono in corso danni fisici, fratture ed infiammazione), si innescano fenomeni di neovascolarizzazione.
Contemporaneamente, siamo a conoscenza del fatto che i microbi intestinali siano in grado di alterare il loro stesso ambiente, favorendo la produzione di varie molecole di segnalazione, cellule immunitarie e metaboliti con potenziali effetti positivi o negativi sul metabolismo osseo. Questi metaboliti e le molecole biologiche associate, potrebbero raggiungere alcuni tessuti ed organi bersaglio a distanza. Fra questi troviamo anche i IVD, dove i composti possono provocare un cambiamento patologico-localizzato ed attraverso la regolazione del microambiente esterno ed interno dei IVD innescare fenomeni degenerativi.
Asse intestino – midollo osseo
Come dimostrato nei modelli animali di artrite, diabete ed obesità, la disbiosi può causare un aumento della permeabilità della barriera epiteliale intestinale ed indurre un’infiammazione di basso grado. In questo contesto vengono altresì prodotti agenti infiammatori specifici come gli acidi grassi a catena corta (SCFA), generati dalla fermentazione di carboidrati complessi, o composti batterici come i LPS (lipopolisaccaridi). L’infiammazione di basso grado, inoltre, può regolare l’espressione del gene della risposta primaria di differenziazione mieloide 88 (MyD88), mentre i batteri intestinali possono influenzare le cellule immunitarie periferiche, le cellule staminali ematopoietiche e progenitrici del midollo osseo (BM – HSPC). Va ricordato, infine, che la colonna vertebrale presenta particolari “nicchie midollari” (aree altamente localizzate e circoscritte ricche di cellule immunitarie); in queste nicchie, la disbiosi intestinale è in grado di causare una formazione aberrante di cellule immunitarie coinvolgenti, a loro volta, il midollo spinale con risvolti potenziali sul LBP.
Asse intestino – osso
Gli ormoni intestinali secreti dalle cellule enteroendocrine (o enterocromaffini), in seguito all’ingestione di nutrienti, modulano diversi processi metabolici: omeostasi del glucosio, la necessità di assunzione di cibo e la regolazione dei processi di rimodellamento osseo. I biomarcatori del turn over osseo, ad esempio, si riducono lentamente dopo l’assunzione di cibo, espletando influenze sul riassorbimento osseo.
Anche gli acidi grassi a catena corta (SCFA) possono indirettamente influenzare il sistema muscolo-scheletrico espletando una funzione di regolazione delle cellule ossee. Il polipeptide inibitorio gastrico (GIP) e il GLP-1 (glucagon-like peptide 1) sono ormoni secreti dall’intestino e responsabili della secrezione di insulina, ormone capace di stimolare la formazione ossea. Effettivamente, il blocco del recettore per il GIP nei topi, ha portato in questi ultimi una diminuzione della densità minerale ossea (BMD) e una diminuzione dei marcatori di formazione ossea, fosfatasi alcalina ed osteocalcina.
L’asse intestino-osso potrebbe pertanto aiutare ad identificare nuovi azioni terapeutiche sia per disturbi ossei sia per il mal di schiena, soprattutto calcolando le positive associazioni fra lombalgia e ridotta densità minerale ossea (BMD).
Traslocazione dei batteri nei dischi intervertebrali (IVD)
Accennati questi concerti preliminari, cerchiamo di comprendere la descrizione che gli autori fanno sul meccanismo di traslocazione dei batteri nei IVD. In corso di disbiosi intestinale, l’indebolimento della barriera epiteliale determina un incremento della propria permeabilità, con un consequenziale aumento dei rapporti fra microbiota intestinale e il sistema immunitario mucosale, determinando una massiccia attivazione di cellule immunitarie. Queste cellule rilasciano grandi quantità di citochine pro-infiammatorie (ad es. IL-6 e TNFa) che possono riversarsi nel flusso sanguigno e migrare verso i IVD, inducendo IDD grazie ad un rimodellamento tessutale immuno-mediato.
Le cellule IVD saranno pertanto indotte a generare fattori neurogeni (es. fattore neurotrofico di derivazione cerebrale o BDNF e fattore di crescita neurale o NGF), con neo-formazione ed attivazione di fibre nervose nocicettive, elevata espressione dei canali cationici e un aumento degli stimoli afferenti ai gangli della radice dorsale (DRG) e centri superiori.
Specificazioni sulla patofisiologia associata
Come accennato, l’infiammazione di basso grado associata alla disbiosi può essere un fattore cruciale per l’insorgenza di malattie muscoloscheletriche (es. artrite reumatoide). Il microambiente di un IVD sano, richiama lontanamente al sistema nervoso centrale (SNC) il quale è considerato un organo privilegiato da un puntò di vista immunitario per via della barriera ematoencefalica (BBB) e della barriera emato-midollare, le quali, separano quest’ultimo da un possibile stato infiammatorio sistemico.
In modalità analoga, il disco intervertebrale è dotato di una barriera protettiva nei confronti delle infezioni sistemiche (barriera emato-discale). Questa barriera, d’altro canto, induce una ridotta sorveglianza immunitaria locale e la riduzione di segnali di avvertimento associati. A tal motivo, le cellule immunitarie non possono sperare in un feedback tempestivo proveniente dal microambiente interno discale, determinando la comparsa di postume ed eccessive reazioni infiammatorie.
La mancanza di una sorveglianza immunitaria e l’ambiente ipossico si presenteranno, di conseguenza, come condizioni ideali per la riproduzione di batteri anaerobici all’interno dei IVD, soprattutto dopo una loro potenziale invasione.
Ora, l’infiammazione intestinale è in grado di promuovere un aumento della permeabilità intestinale, consentendo a più batteri (e loro metaboliti) di attraversare le barriere tissutali e mucosali, riversandosi nel circolo vascolare. Sebbene la maggior parte dei batteri traslocati venga distrutta rapidamente dal sistema immunitario, alcuni batteri possono sopravvivere eludendo la risposta immunitaria e giungere attraverso il sistema vascolare fino ai IVD, dove il rilascio di fattori pro-infiammatori (es. IL-6 e TNF-a) porterà al reclutamento di cellule infiammatorie (es. cellule T, cellule B, cellule dendritiche e macrofagi). L’infiltrazione cellulare e la risposta infiammatoria associata, come precedentemente accennato, può portare alla neo-formazione di vasi sanguigni nei IVD, causando un sovvertimento dello stato ambientale anaerobico dei IVD.
Se a questi meccanismi aggiungiamo la presenza di carichi meccanici anomali e lesioni microscopiche continuative, potrebbero palesarsi ulteriori danni irreversibili (es. microfratture). In questo contesto, verrebbero ulteriormente a crearsi condizioni ideali per la riproduzione e la crescita di batteri, la cui presenza porterebbe ad una generale amplificazione del danno anatomico.
Le cellule degli stessi IVD lesionati, infatti, sarebbero indotti a secernere citochine infiammatorie (es. IL-1a/B, IL-17, TNF-α e IL-6) portando ad una ulteriore distruzione della matrice extracellulare (ECM), alla promozione della degradazione del collagene ed inducendo un’ulteriore produzione di chemochine.
Per di più, l’infiammazione all’interno dei IVD, è induttiva di uno squilibrio fra le risposte cellulari anaboliche e cataboliche, determinando degenerazione (IDD), ernia e possibile mal di schiena di origine discogena. Infine, non va escluso e dimenticato come fenomeni simili potrebbero essere indotti anche dal rilascio di lipopolisaccaridi (LPS) da parte della popolazione batterica infiltrata nei IVD.
PER APPROFONDIMENTI:
– https://doi.org/10.1007/s00586-022-07152-8
– https://doi.org/10.1002/art.41780
– doi: 10.1177/1759720X21996973
–https://doi.org/10.1016/j.autrev.2013.06.006
– doi: 10.3748/wjg.15.5517








Da sempre ho pensato che ci fosse più di una correlazione e ancora c’è un mondo da scoprire, da questo punto di vista la bromatech mi ha aiutato tanto nel comprendere la fisiopatologia del sistema asse intestino S. I. e cervello!! Noi osteopati potremmo avere un ruolo chiave nella risoluzione di determinate patologie! Complimenti per l’articolo dott. Pranzitelli!!
Bellissimo articolo… Compleanno
Bellissimo articolo… Complimenti!
Altro mito che decade: la sterilità dei dischi intervertebrali. Ottimo articolo, grazie.
Mario Frusi, medico.
Salve, ho 40 anni e mi trovo in una situazione problematica di ernie e protusioni discali, soprattutto dorsali ( peraltro le più rare), non dovute a traumi.
Sono arrivato a leggere il suo articolo perché ho sofferto negli ultimi due anni di infiammazioni intestinali e cercavo una correlazione.
Cosa consiglia di fare per capire se mi possa trovare in una delle situazioni descritte nell’articolo?
Cordiali saluti
Buongiorno, ha provato a consultare un osteopata? In questa sezione può trovare l’osteopata più vicino a lei.
https://www.tuttosteopatia.it/osteopati/ricerca?wpv_post_search=&filterby-regioni=0&wpv_filter_submit=Cerca