Osteopatia Cranio sacrale Ricerca osteopatica
L’inaspettato ruolo dei legamenti gialli nella stenosi del canale vertebrale
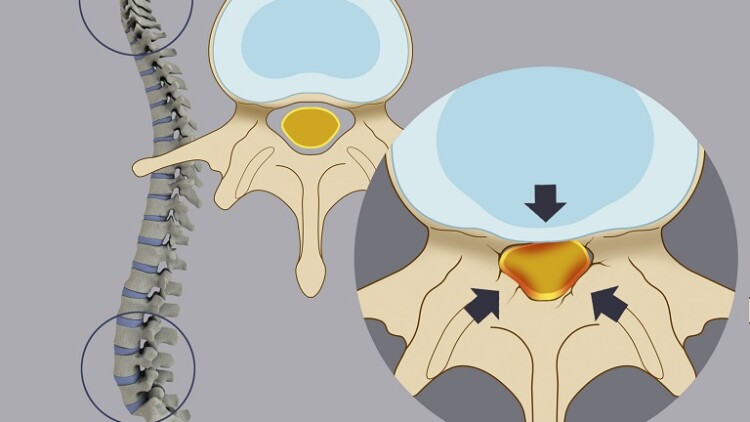
La Stenosi Spinale (SS) è un particolare disturbo clinico caratterizzato da un graduale e non-fisiologico restringimento del canale vertebrale. Questa graduale variazione del diametro dei forami vertebrali, porta nel tempo ad una progressiva ed inevitabile compressione delle componenti anatomiche contenute nel canale stesso (midollo spinale, nervi spinali), determinando così la comparsa di segni e sintomi neurologici tipici quali claudicatio neurogena, lombosciatalgia, iporeflessia, ipoestesie e parestesie.
In alcuni casi, il quadro sintomatologico diviene talmente invalidante da incidere notevolmente sulla qualità della vita della persona ed interferire sulle normali attività di vita quotidiana e, in caso di fallimento delle strategie terapeutiche conservative (es. farmaci antinfiammatori, fisioterapia, terapia manuale, iniezioni di steroidi epidurali), l’intervento chirurgico decompressivo risulta essere l’unica alternativa possibile per i pazienti.
Benché l’intervento chirurgico porti un relativo e temporaneo alleviamento dei sintomi, una remissione completa dal disturbo non è sempre garantita e, a seconda della tipologia di SS (sia essa congenita, traumatica o degenerativa) è possibile delineare differenti esiti prognostici. Ad esempio è stato notato come la stenosi costituzionale evolutiva, ovvero la variante congenita della stenosi, presenti alte probabilità di re-intervento.
Ma cosa sappiamo, attualmente, sulla eziopatogenesi della Stenosi?
Negli ultimi anni è stata data molta attenzione al ruolo patogenetico dei legamenti gialli (LG) nella genesi di questo disturbo. Il LG è un legamento interlaminario di forma rettangolare, relativamente elastico e che delimita posteriormente il canale vertebrale in tutta la sua estensione. Nei pazienti affetti da SS i legamenti gialli si presentano ipertrofici, invadendo di conseguenza il canale vertebrale. La causa sottostante questa ipertrofia rimane controversa, minando la possibilità di elaborare nuove strategie terapeutiche.
I ricercatori Cheung et al. (2016), in un loro recente articolo, hanno riassunto le principali teorie alla base del fenomeno ipertrofico ligamentoso, teorie che attualmente non escludono la possibilità di altri meccanismi patogenetici sconosciuti. In primo luogo è stato ipotizzato come l’ipertrofia dei LG sia un fenomeno “apparente”, ovvero risultante dalla riduzione dell’altezza del disco e della degenerazione discale: la perdita di altezza del disco causerebbe una lassità nei tessuti legamentosi, portando alla deformazione del LG ed a una sua invaginazione all’interno del canale vertebrale.
La seconda ipotesi, probabilmente la più accreditata, riconduce le cause dell’ipertrofia a fenomeni di fibrotizzazione e alterazione istologica dei LG (Sairyo K et al. 2005; Chen J. 2014). La causa sottostante questa modificazione tissutale non è stata ancora chiarita, si contempla la possibile influenza di elementi caratteristici quali ipossia, stress tissutale, infiammazione e produzione di biomarker up-regolatori dei fibroblasti. Questi fenomeni potrebbero causare un aumento della produzione delle fibre di collagene a discapito della quota di elastina prodotta.
Il supporto scientifico alle teorie riguardanti i parametri di alterata sintesi di collagene, fibrosi e degradazione delle fibre elastiche non mancano (Sairyo K. Et al. 2007; Yoshida M et al. 1992; Chen J et.al. 2014, Zhong ZM et al. 2011, Zhang K. Et al. 2016; Schrader PK et al. 1999; Yabe Y. Et al. 2015), così come non mancano testimonianze della produzione di composti molecolari correlati allo stato infiammatorio (prove della produzione di IL-6, ANGPTL2 e TGF-β1 sono state osservate da Chokshi FH et al. 2010, Nakamura T et al. 2015, Park, Jong-Beom et al. 2001).
Eppure, il recente articolo di Cheung et al. (2016), ha evidenziato fenomeni “paradossali” nel rapporto fibrotizzazione/stato ipertrofico. Nella loro ricerca sono stati reclutati prospetticamente 34 pazienti (19 femmine con età media di 67,1 ± 10,4 anni, 15 maschi con età media di 64,4 ± 11,0 anni) candidati ad intervento chirurgico decompressivo. Mediante l’ausilio di risonanza magnetica sono state analizzate le strutture rachidee comprese fra L1 ed S1 per un totale di 380 forami vertebrali, 190 dischi intervertebrali e relativi legamenti. Inoltre è stato effettuato l’esame istologico dei legamenti gialli prelevati durante gli interventi chirurgici. Dall’analisi sono emerse interessanti conclusioni: la fibrosi è correlabile all’ipertrofia solo in alcune tipologie di stenosi. Nei gruppi con stenosi congenita, ad esempio, è risultata una correlazione negativa fra lo spessore dei legamenti gialli ed il grado di fibrotizzazione, mentre nel gruppo con stenosi non congenita vi è una significativa e positiva correlazione fra i due parametri.
A queste osservazioni, si sono aggiunte recenti considerazioni da parte di Jakub Jezek et al. (2020), i quali hanno escluso il rapporto fra ipertrofia dei LG, fenomeni infiammatori e modificazioni vascolari. Secondo i ricercatori, infatti, la vascolarizzazione è soggetta a modificazioni fisiologiche età-dipendenti che tendono a stabilizzarsi dopo i 50 anni e pertanto non possono essere ricondotte ad una chiara fenomenologia infiammatoria.
Il lavoro di Jezek et al. ha permesso di rispondere alle ipotesi avanzate, verso la fine degli anni novanta, dai ricercatori Peter K. Schräder et al (1999), i quali enunciavano come i processi di fibrotizzazione e calcificazione del legamento giallo fossero correlati ad un fisiologico processo di invecchiamento.
Inoltre tali osservazioni hanno permesso di rafforzare le considerazioni dei ricercatori Benditz et al. (2019) secondo i quali i parametri di disabilità, dolore e i pattern fenomenologici clinici della SS, siano correlati più ad un patologico aumento del numero di fibre nervose sensoriali (iper-innervazione patologica dei LG) piuttosto che a fenomeni infiammatori o vascolari (che non sono stati riscontrati nei gruppi campione esaminati).
Nonostante l’enorme mole di dati clinici raccolti, siamo ancora lontani dal fornire una risposta certa circa l’eziopatogenesi dell’ipertrofia dei LG ed attendiamo nuovi studi che possano finalmente fornire risposte chiare e risolutive a questo fastidioso problema.
Fonti Bibliografiche
- Benditz, Achim, et al. “Increased pain and sensory hyperinnervation of the ligamentum flavum in patients with lumbar spinal stenosis.”
Journal of Orthopaedic Research® 37.3 (2019): 737-743. - Chen J, Liu Z, Zhong G, Qian L, Li Z, Qiao Z et al. Hypertrophy of ligamentum flavum in lumbar spine stenosis is associated with increased miR-155 level.
Dis Markers. 2014;2014:786543. - Cheung, Prudence Wing Hang, et al. “The paradoxical relationship between ligamentum flavum hypertrophy and developmental lumbar spinal stenosis.”
Scoliosis and spinal disorders 11.1 (2016): 26. - Chokshi FH, Quencer RM, Smoker WR. The “thickened” ligamentum flavum: is it buckling or enlargement?
AJNR Am J Neuroradiol. 2010;31:1813–6. - Jakub Jezek et al. The role of vascularization on changes in ligamentum flavum mechanical properties and development of hypertrophy in patients with lumbar spinal stenosis.
The Spine Journal (2020). - Nakamura T, Okada T, Endo M, Nakamura T, Oike Y, Mizuta H. Angiopoietin-like protein 2 promotes inflammatory conditions in the ligamentum flavum in the pathogenesis of lumbar spinal canal stenosis by activating interleukin-6 expression.
Eur Spine J. 2015;24:2001–9. - Park, Jong-Beom, Han Chang, and Jin-Kyung Lee. “Quantitative analysis of transforming growth factor-beta 1 in ligamentum flavum of lumbar spinal stenosis and disc herniation.”
Spine 26.21 (2001): E492-E495.) - Sairyo K, Biyani A, Goel V, Leaman D, Booth Jr R, Thomas J, et al. Pathomechanism of ligamentum flavum hypertrophy: a multidisciplinary investigation based on clinical, biomechanical, histologic, and biologic assessments.
Spine. 2005;30:2649–56. - Sairyo K, Biyani A, Goel V, Leaman D, Booth RJ, Thomas J, et al. Lumbar ligamentum flavum hypertrophy is due to accumulation of inflammation related scar tissue.
Spine. 2007;32:E340–E7. - Schräder, P. K., et al. “Histology of the ligamentum flavum in patients with degenerative lumbar spinal stenosis.”
European Spine Journal 8.4 (1999): 323-328. - Yabe Y, Hagiwara Y, Ando A, Tsuchiya M, Minowa T, Takemura T, et al. Chondrogenic and fibrotic process in the ligamentum flavum of patients with lumbar spinal canal stenosis.
Spine. 2015;40:429–35. - Yoshida M, Shima K, Taniguchi Y, Tamaki T, Tanaka T. Hypertrophied ligamentum flavum in lumbar spinal canal stenosis. Pathogenesis and morphologic and immunohistochemical observation.
Spine. 1992;17:1353–60 - Zhang K, Sun W, Liu XY, Zhao CQ, Li H, Sun XJ et al. Hypertrophy and Fibrosis of the Ligamentum Flavum in Lumbar Spinal Stenosis is Associated with Increased Expression of LPA and LPAR1. Clin Spine Surg. 2016.
- Zhong ZM, Zha DS, Xiao WD, Wu SH, Wu Q, Zhang Y, et al. Hypertrophy of ligamentum flavum in lumbar spine stenosis associated with the increased expression of connective tissue growth factor.
J Orthop Res. 2011;29:1592–7.