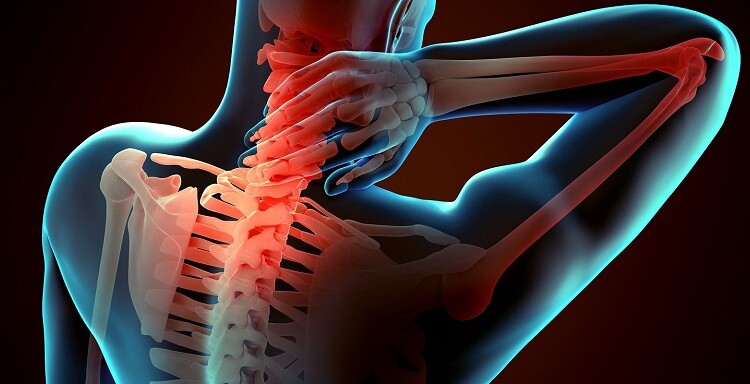
Il dolore muscolo-scheletrico (MSK-P) si sta rivelando la principale causa di disabilità su scala internazionale (Vos T. et al 2017), determinando grandi oneri per l’intera società e rendendo necessario un cambiamento nelle strategie di cura ed assistenza sanitaria.
Secondo alcuni report, infatti, le modalità di gestione dei pazienti con disturbi muscolo-scheletrici sarebbero tutt’ora inadeguate e caratterizzate da scarsa qualità, lacune nei processi “evidence-to-practice” (dall’evidenza alla pratica clinica) con conseguente spreco di risorse (Buchbinder R et al. 2018). Affinare gli approcci al dolore muscolo-scheletrico (MSK-P) è diventata dunque un’urgenza improrogabile per medici, servizi sanitari, ricercatori e coordinatori politici.
In questo contesto, alcuni esperti (Eccles MP et al. 2012) premono sull’importanza della stesura di corrette linee guida per la pratica clinica (CPG), ovvero, di idonee “raccomandazioni intese a ottimizzare la cura del paziente e fondate su una revisione sistematica delle prove e valutazioni dei benefici/danni derivabili dalle opzioni di cura alternative ” (Institute of Medicine, 2011) e che potrebbero garantire migliori risultati a costi inferiori.
Mossi da tali circostanze, i ricercatori Ivan Lin et al. (Lin I et al. 2020) hanno condotto e pubblicato sul “British Journal Of Sport Medicine” un virtuoso lavoro di revisione sistematica, valutazione critica e sintesi narrativa delle più moderne CPG sul dolore muscolo-scheletrico, evidenziando gli errori comunemente commessi durante le procedure di assistenza sanitaria e proponendo principi generali utili a migliorarne l’efficienza.
Errori metodologici nel processo di cura
Nello studio, vengono riportati alcuni esempi di errata gestione clinica dei pazienti con disturbi muscolo-scheletrici. Fra questi troviamo:
- Uso eccessivo di imaging: nonostante i risultati raccolti negli ultimi decenni dimostrino una scarsa relazione tra imaging e sintomi riportati (l’imaging non fa la diagnosi) e, nonostante le moderne linee guida sconsigliano un uso routinario di mezzi diagnostici se non in presenza di reali o presunti danni anatomici, il 25%-42% dei pazienti con lombalgia (LBP) viene sottoposto ad imaging. Altri dati riporterebbero che il 69% dei medici di medicina generale, di fronte ad un primo esordio di tendinopatia, indirizzerebbero i pazienti verso un approfondimento radiologico, mentre un 82% farebbe riferimento ecografico per problematiche localizzate alla cuffia dei rotatori;
- Uso eccessivo della chirurgia: in caso di gonartrosi, l’artroscopia non dovrebbe essere raccomandata, tuttavia, il suo tasso di utilizzo nella popolazione generale degli Stati Uniti è aumentata dal 3% al 4%. Il tasso di interventi di decompressione sub-acromiale e riparazione chirurgica della cuffia dei rotatori, è aumentato notevolmente nonostante le prove asseriscano che i risultati degli interventi siano equiparabili alla semplice riabilitazione o alla chirurgia-placebo.
- Uso eccessivo di oppioidi: l’efficacia degli oppioidi per la gestione del dolore MSK è discutibile, sia per le condizioni di dolore cronico sia per le problematiche in acuto. Ad esempio, l’uso precoce di oppioidi nella cura del LBP è stato associato ad esiti statisticamente peggiori. Nonostante tutto, vi è un uso crescente di oppioidi ed una diffusione epidemica dei danni farmaco-correlati.
- Mancanza di istruzione e consulenza dei pazienti: educare i pazienti ad una corretta gestione del dolore MSK dovrebbe essere una prassi più che comune, tuttavia, solo il 20% dei pazienti con LBP ha ricevuto consulenza e istruzione in un contesto di cure primarie.
I criteri di identificazione delle raccomandazioni
Gli autori hanno elaborato un sunto delle principali macro-categorie di riferimento intorno alle quali si orienterebbero le raccomandazioni EBP. In particolare sono state redatte categorie inerenti a:
- Ciò che il paziente DOVREBBE fare: ovvero, quelle raccomandazioni applicabili in tutte le circostanze (ad esclusione di cause oggettivamente controindicate) e basate su prove di evidenza, studi di alta qualità, effetti positivi clinicamente rilevanti, benefici eccedenti rischi o su opinioni condivise dei membri appartenenti ai gruppi di sviluppo delle CPG;
- Ciò che il paziente POTREBBE fare: ovvero, raccomandazioni applicabili a seconda delle circostanze, in quanto basate su prove coerenti ma derivanti da studi di qualità inferiore o da un unico studio di alta qualità e ricerche in cui si attesta come i benefici riscontrati hanno superano i danni potenziali;
- Ciò che il paziente NON DOVREBBE fare: queste raccomandazioni rientrano in un contesto di evidente ASSENZA di benefici e/o possibilità che i danni conseguenti alla terapia siano superiori ai benefici;
- Raccomandazioni INCERTE: in questa categoria rientrano principi o approcci che hanno riportato risultati incompleti/incoerenti e che non permettono giudizi favorevoli o contrari alla terapia.
Le 11 raccomandazioni per un approccio evoluto ai problemi muscolo-scheletrici:
Elaborate le macro-categorie, gli autori hanno sintetizzato le raccomandazioni nei seguenti 11 punti:
- Assicurarsi che l’assistenza sia centrata sul paziente ed elaborata a misura del singolo caso: l’assistenza centrata sul paziente include la fornitura di un’assistenza personalizzata e contestuale (paziente e sue preferenze/caratteristiche), l’elaborazione di un processo decisionale condiviso e l’utilizzo di una comunicazione efficace.
- Individuare eventuali red flags: Sette CPG hanno sottolineato la necessità di individuare, evidenziare ed escludere, in fase di valutazione iniziale, eventuali red flag nel paziente. Devono essere scartati sospetti di infezione, malignità, frattura, deficit neurologici gravi e progressivi (es. sindrome della cauda equina) e condizioni gravi che potrebbero mascherarsi da dolore MSK (es. aneurisma aortico).
- Valutare i fattori psicosociali: nove CPG (quattro per lombalgia, due per cervicalgia, due per osteoartrosi, uno per disturbi della cuffia dei rotatori) hanno raccomandato la valutazione dei fattori psicosociali (yellow flags), fra cui troviamo: stato d’animo, umore, emozioni, depressione, ansia, paura, relazioni sociali, chinesiofobia ed aspettative di recupero. Inoltre, due CPG inerenti il LBP, al fine di identificare i fattori di rischio prognostico di natura psicosociale e contestualizzare l’assistenza ad un livello di rischio corrispondente, raccomandano l’utilizzo di strumenti di screening muscolo-scheletrico (es. STarT Back o Orebro).
- Utilizzare l’imaging in modo selettivo: ovvero, ricorrere all’imaging solo in presenza di sospetta red flag, insoddisfacente risposta alle cure conservative, progressione inspiegabile dei segni/sintomi del paziente e quando diventa probabile la necessita di cambiamenti della gestione clinica. Sei CPG hanno scoraggiato l’uso routinario dell’imaging radiologica, a meno che non si sospetti una patologia grave. Due CPG sul LBP hanno raccomandato di spiegare ai pazienti che l’imaging potrebbe non essere necessaria. Solo un CPG in ambito chiropratico ha raccomandato di prendere in considerazione l’imaging se vi è “il sospetto di un’anomalia anatomica sottostante, come la spondilolistesi, la spondilosi da moderata a grave” o “instabilità meccanica”. Il NICE CPG sull’ Osteoartrosi ha incoraggiato invece la diagnosi clinica di senza ricorrere ad imaging.
- Eseguire un esame fisico come lo screening neurologico, test di mobilità e forza: sette CPG raccomandavano di effettuare un esame fisico per valutare le condizioni di dolore MSK. Le valutazioni fisiche includono test di mobilità, motilità, forza, posizione e propriocezione. I CPG per il dolore spinale consigliavano anche test di funzione neurologica. Lo scopo di questi esami fisici dovrebbe essere quello di dare un supporto aggiuntivo alla diagnosi ed alla classificazione dei disturbi MSK. Per la spalla, questo include la differenziazione tra l’origine del dolore tendineo, articolare o riferito. Per differenziare il dolore di origine radicolare sono consigliati i test neurologici. Nonostante un CPG abbia riportato una mancanza di supporto empirico per le valutazioni fisiche, la conclusione è stata che “le ripercussioni della mancata esecuzione di un esame potrebbero portare ad insoddisfazioni da parte dei pazienti e richieste ingiustificate di test o ulteriori rinvii”.
- Monitorare i progressi del paziente con gli strumenti clinici a disposizione (es. questionari, test ed inventory): cinque CPG hanno raccomandato di valutare i progressi del paziente con misure di outcome convalidate.
- Fornire istruzioni/informazioni sul self-management del problema: Dieci CPG raccomandano di fornire istruzione o informazioni per incoraggiare l’autogestione sintomatologica del paziente ed informare/rassicurare i pazienti sulla loro condizione e capacità auto-gestiva. In tutte le CPG, l’istruzione e l’informazione del paziente è stata raccomandata dunque come parte del “pacchetto di cura”. Diversi CPG inoltre, hanno sottolineato la necessità di un’istruzione personalizzata in base alle necessità del paziente.
- Far eseguire sempre esercizio fisico: Tutti i CPG includevano raccomandazioni relative all’attività fisica ed esercizio, orientandosi sia sull’esercizio di tipo aerobico, di rafforzamento muscolare, mobilità ed elasticità. Tre CPG hanno raccomandato che l’esercizio debba essere supervisionato da un esperto.
- Utilizzare la terapia manuale solo come integrazione ed in aggiunta ad altri trattamenti/consigli evidence-based: in sette CPG, la terapia manuale era una raccomandazione inerente il “ciò che il paziente POTREBBE fare” (una possibilità più che una necessità) mentre in un CPG la terapia manuale rientrava nelle raccomandazioni di necessità. Di base, piuttosto che essere utilizzata come unico trattamento, la terapia manuale dovrebbe essere raccomandata come componente dell’assistenza multimodale ed inclusa con altre strategie di gestione (es. esercizio fisico, terapia psicologica, informazione/educazione del paziente, consigli sull’attività).
- Offrire assistenza non chirurgica, di qualità, prima di sbilanciarsi verso un intervento chirurgico: quattro CPG hanno raccomandato che ai pazienti venissero forniti trattamenti conservativi prima di considerare qualsiasi intervento chirurgico. Un CPG per i disturbi della cuffia dei rotatori specifica chiaramente la possibilità di optare per “tempo di prova”, pari a 3 mesi, in cui monitorizzare se i trattamenti conservativi possano sostituire l’intervento chirurgico.
- Mantenere sempre i pazienti attivi, scoraggiando l’inattività e consigliando il ritorno alle attività lavorative: cinque CPG hanno offerto raccomandazioni di necessità rispetto al re-impiego ed alla continuazione delle attività lavorative quando i pazienti sono soggetti a dolore MSK. Rimanere attivi evitando l’inattività, aumentare gradualmente i livelli di attività ed il coinvolgimento lavorativo sono principi condivisi e consigliabili in tutte le forme di disturbi MSK.
Esempi clinici allegati
Osteoartrite (OA)
- Offrire programmi di autogestione;
- Fornire interventi mirati alla perdita di peso se i pazienti sono in sovrappeso o obesi;
- Non utilizzare glucosamina o condroitina per indurre modificazioni dello stato di malattia;
- Non eseguire il lavaggio artroscopico/debridement del ginocchio a meno che non vi sia un razionale terapeutico (es. blocco meccanico del ginocchio).
Lombalgia(LBP)
- Non proporre il paracetamolo come singolo farmaco;
- Non proporre oppioidi in caso di mal di schiena cronico;
- Non proporre inibitori del re-uptake della serotonina (o della serotonina-norepinefrina), antidepressivi triciclici o farmaci anticonvulsivi;
- Non proporre scarpe ortopediche o plantari;
- Non proporre interventi di rimozione del disco;
- Non utilizzare iniezioni spinali (es. a livello delle faccette articolari, blocchi di plessi, iniezioni intradiscali, proloterapia e iniezioni di punti trigger);
Fonte
Lin I, Wiles L, Waller R, et al. Br J Sports Med 2020;54:79–86.
Riferimenti bibliografici aggiuntivi
Buchbinder R, van Tulder M, Öberg B, et al. Low back pain: a call for action. Lancet 2018;391:2384–8.
Eccles MP, Grimshaw JM, Shekelle P, et al. Developing clinical practice guidelines: target audiences, identifying topics for guidelines, guideline group composition and functioning and conflicts of interest. Implement Sci 2012;7:60.
IOM (Institute of Medicine). Clinical practice guidelines we can trust. Washington (DC): National Academies Press, 2011
Vos T, Abajobir AA, Abate KH, et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet 2017;390:1211–59.